SILAHKAN KALIAN KLIK DISINI UNTUK MEMPEROLEH LINK SOAL
SILAHKAN KERJAKAN DENGAN TELITI, TEPAT, DAN JUJUR
APABILA TERDAPAT KESULITAN TEKNIS SEGERA HUBUNGI GURU YANG BERSANGKUTAN
SILAHKAN KALIAN KLIK DISINI UNTUK MEMPEROLEH LINK SOAL
SILAHKAN KERJAKAN DENGAN TELITI, TEPAT, DAN JUJUR
APABILA TERDAPAT KESULITAN TEKNIS SEGERA HUBUNGI GURU YANG BERSANGKUTAN
Elektron valensi adalah elektron dalam atom yang berperan dalam pembentukan ikatan kimia. Pada unsur-unsur golongan utama (IA, IIA, IIIA, hingga VIIIA), elektron valensi adalah elektron yang berada pada kulit elektron terluar.
Oleh karena itu, kulit elektron terluar sering disebut sebagai kulit valensi. Namun, perlu diperhatikan bahwa tidak semua elektron valensi hanya berada pada kulit terluar. Elektron valensi unsur-unsur golongan transisi dapat berada pada kulit elektron yang lebih dalam dari kulit terluar.
Konfigurasi elektron merupakan susunan persebaran (distribusi) elektron-elektron dalam atom. Elektron hanya dapat berada pada lintasan peredaran elektron tertentu dalam atom, bergantung pada level energinya. Lintasan peredaran elektron ini disebut juga sebagai kulit elektron. Kulit elektron pertama yang terdekat dengan inti atom disebut kulit K, kemudian kulit kedua disebut kulit L, kulit ketiga disebut kulit M, dan seterusnya berurut berdasarkan alfabet.
Setiap kulit elektron hanya dapat terisi sejumlah tertentu elektron. Jumlah maksimum elektron yang dapat terisi pada kulit elektron ke-n adalah 2n2, di mana n adalah nomor kulit atau bilangan kuantum utama.
Elektron-elektron akan mengisi kulit-kulit elektron pada atom dimulai dari kulit pertama yang terdekat dengan inti, yakni kulit K yang merupakan level energi yang terendah. Jika kulit K telah terisi penuh dengan 2 elektron, selanjutnya elektron akan mengisi kulit L. Lalu jika kulit L telah terisi penuh dengan 8 elektron, selanjutnya elektron akan mengisi kulit M, N, dan seterusnya secara bertahap. Namun, jumlah maksimum elektron pada kulit terluar (kulit valensi) dari suatu atom adalah 8.

Ilustrasi konfigurasi elektron atom Li, B, O, Ne, Na, dan K berdasarkan kulit elektron
(Sumber: Spencer, James N., Bodner, George M., & Rickard, Lyman H. 2011. Chemistry: Structure and Dynamics (5th edition). New Jersey: John Wiley & Sons, Inc.)
Untuk atom unsur golongan utama, penentuan konfigurasi elektron berdasarkan nomor atom atau jumlah elektronnya dapat mengikuti aturan sebagai berikut.
Berikut tabel yang menunjukkan konfigurasi elektron dari beberapa unsur berdasarkan kulit elektron.

Pada tabel tersebut terlihat konfigurasi elektron atom unsur-unsur transisi seperti Sc, Ti, Cr, Cu, dan Zn. Bila diperhatikan, konfigurasi elektron untuk unsur Sc, Ti, dan Cr tidak mengikuti aturan konfigurasi berdasarkan kulit elektron seperti yang telah dijelaskan di atas. Hal ini dikarenakan penentuan konfigurasi elektron atom unsur golongan transisi hanya dapat didasarkan pada orbital atom. Jadi, untuk atom unsur golongan transisi, aturan penentuan konfigurasi elektronnya lebih kompleks.
Penentuan konfigurasi elektron berdasarkan orbital atom akan dibahas dalam bab “Bilangan Kuantum”. Setiap orbital dalam atom akan ditandai dengan satu set nilai bilangan kuantum utama (n), bilangan kuantum azimuth (l), dan bilangan kuantum magnetik (ml) yang khusus. Lalu, setiap orbital maksimum terisi 2 elektron, yang masing-masing memiliki bilangan kuantum spin (ms) tersendiri. Keempat bilangan kuantum tersebut digunakan untuk mendeskripsikan energi elektron, sebagaimana seperti “alamat” elektron dalam sebuah atom untuk menemukan probabilitas keberadaan elektron dalam atom tersebut.
Sifat-sifat dari suatu unsur sangat bergantung pada konfigurasi elektronnya, terutama pada jumlah elektron valensinya. Unsur-unsur dengan jumlah elektron valensi yang sama umumnya memiliki kemiripan sifat. Oleh karena sistem periodik unsur disusun berdasarkan kenaikan nomor atom dan kemiripan sifat, terdapat hubungan antara konfigurasi elektron atom unsur dan letak unsur dalam sistem periodik, di mana:
Tentukan konfigurasi elektron dari atom dan ion unsur-unsur berikut.
a. Ca (Z = 20)
b. Cs (Z = 55)
Jawab:
a. Ca (Z = 20) menunjukkan bahwa atom Ca memiliki 20 proton dan 20 elektron.
20 elektron atom Ca akan mengisi penuh kulit K (2 e−) dan kulit L (8 e−) sehingga tersisa 20 − (2 + 8) = 10 elektron.
Karena jumlah elektron tersisa < 18, maka kulit selanjutnya, yakni kulit M, akan diisi oleh 8 e−. Dengan demikian, tersisa 20 − (2 + 8 + 8) = 2 elektron.
Karena jumlah elektron tersisa ≤ 8, maka kulit selanjutnya, yakni kulit N, akan diisi oleh semua elektron yang masih tersisa, yaitu sejumlah 2 elektron.
Jadi, konfigurasi elektron atom Ca adalah 20Ca : 2 8 8 2
b. Cs (Z = 55) menunjukkan bahwa atom Cs memiliki 55 proton dan 55 elektron.
55 elektron atom Cs akan mengisi penuh kulit K (2 e−), kulit L (8 e−), dan kulit M (18 e−) sehingga tersisa 55 − (2 + 8 + 18) = 27 elektron.
Karena jumlah elektron tersisa < 32, maka kulit selanjutnya, yakni kulit N, akan diisi oleh 18 e−. Dengan demikian, tersisa 20 − (2 + 8 + 18 + 18) = 9 elektron.
Karena jumlah elektron tersisa < 18, maka kulit selanjutnya, yakni kulit O, akan diisi oleh 8 e−. Dengan demikian, tersisa 20 − (2 + 8 + 18 + 18 + 8) = 1 elektron.
Karena jumlah elektron tersisa ≤ 8, maka kulit selanjutnya, yakni kulit P, akan diisi oleh semua elektron yang masih tersisa, yaitu sejumlah 1 elektron.
Jadi, konfigurasi elektron atom Cs adalah 55Cs : 2 8 18 18 8 1
SOAL
Tentukan Konfigurasi Eleketron dari atom-atom berikut:
1. 5B
2. 8O
3. 11Na
4.13Al
5. 16S
Elektron Valensi – Referensi
Earl, Bryan & Wilford, Doug. 2014. Cambridge IGCSE® Chemistry (3rd edition). London: Hodder Education
Purba, Michael. 2006. Kimia 1A untuk SMA Kelas X. Jakarta: Erlangga
Spencer, James N., Bodner, George M., & Rickard, Lyman H. 2011. Chemistry: Structure and Dynamics (5th edition). New Jersey: John Wiley & Sons, Inc.
Stacy, Angelica M. 2015. Living by Chemistry (2nd edition). New York: W.H. Freeman and Company
Artikel: Elektron Valensi
Kontributor: Nirwan Susianto, S.Si.
Alumni Kimia FMIPA UI
Materi StudioBelajar.com

Konfigurasi elektron adalah susunan elektron berdasarkan kulit atau orbital dari suatu atom. Jadi ada dua cara menyatakan konfigurasi elektron nih. Namun konfigurasi elektron berdasarkan orbital atom itu, lebih berguna untuk mempelajari sifat-sifat suatu zat kimia, termasuk mengapa ada zat kimia yang berwarna-warni. Jadi yang dibahas di sini adalah bagaimana membuat konfigurasi elektron berdasarkan orbital suatu atom ya.
Nah, ada satu gambar yang harus kalian pahami dulu sebelum membuat konfigurasi elektron berdasarkan orbital atom. Coba perhatikan gambar di bawah ini.

Wow, apa tuh? Uler-uleran? Bukan dong. Itu adalah urutan tingkat energi kulit dan subkulit suatu atom. Ada 4 subkulit yaitu s, p, d, dan f dan angka sebelum subkulit menunjukkan kulit. Subkulit 1s punya tingkat energi paling rendah, lalu naik ke subkulit 2s, 2p, 3s, 3p, sampai terakhir yang paling tinggi 8s. Pastinya elektron yang bisa mengisi subkulit tertentu juga terbatas. Elektron yang mengisi subkulit ini dituliskan dalam bentuk pangkat. Subkulit s maksimal terisi 2 elektron ![]() , p terisi 6 elektron
, p terisi 6 elektron ![]() , d terisi 10 elektron
, d terisi 10 elektron ![]() , dan f terisi 14 elektron
, dan f terisi 14 elektron ![]() .
.
Saat menuliskan konfigurasi elektron, kita harus menuliskannya secara urut berdasarkan tingkat energi subkulit dari yang terendah ke tertinggi. Coba nih lihat contoh konfigurasi elektron atom karbon.

Kok bisa gitu ya konfigurasi elektron atom karbon? Coba kita ulik satu persatu ya. Karbon punya 6 elektron. Kita harus menuliskan konfigurasi untuk 6 elektron ini. Padahal elektron yang menempati suatu subkulit bisa dilihat dari pangkat subkulitnya. Kalau kita jumlahkan pangkatnya dari  maka pas 6 kan? Jadi, dalam menuliskan konfigurasi elektron, ikuti saja urutan tingkat energi kulit dan subkulitnya sampai pangkatnya sama seperti banyaknya elektron yang dipunyai atom itu.
maka pas 6 kan? Jadi, dalam menuliskan konfigurasi elektron, ikuti saja urutan tingkat energi kulit dan subkulitnya sampai pangkatnya sama seperti banyaknya elektron yang dipunyai atom itu.
Terus zat kimia dengan konfigurasi elektron seperti apa ya yang bisa menghasilkan warna? Biasanya, zat kimia dari logam transisi (golongan B) yang bisa menghasilkan warna. Ambil contoh Mangan (Mn). Seperti apa tuh konfigurasi elektron mangan? Coba perhatikan gambar di bawah ini.

Mn punya subkulit d di akhir konfigurasi elektronnya kan? Subkulit d ini yang biasanya akan mengalami proses kimia lebih lanjut sehingga menghasilkan warna. Itu sebabnya sebagian besar zat kimia dari logam transisi bisa menghasilkan warna. Gimana? Paham kan? Kalau sudah, kita lanjut, yuk!

Nah sekarang kita akan menggambarkan konfigurasi elektron memakai diagram orbital, Squad. Sebenarnya gambarnya cukup mudah kok. Suatu subkulit punya sejumlah orbital. Orbital itu digambarkan sebagai persegi dan berisi garis setengah panah yang mewakili elektron. Subkulit s punya 1 orbital, p punya 3 orbital, d punya 5 orbital, dan f 14 orbital. Ada aturan-aturannya lho dalam menggambar diagram orbital.

Kalau sudah tahu aturan-aturannya, langsung aja deh kita lihat contoh diagram orbital untuk beberapa atom berikut.

Sama seperti konfigurasi elektron, diagram orbital juga dipakai diperlukan untuk mempelajari mengapa zat-zat kimia mempunyai warna lho. Diagram orbital bisa menggambarkan mengapa ada zat yang warnanya ungu, hijau, atau bahkan tidak berwarna walaupun ia merupakan logam transisi. Misalnya pada logam transisi yang tidak berwarna Zn, bila kita gambarkan diagram orbitalnya, akan terlihat perbedaan diagram orbital antara logam itu dengan logam transisi berwarna lain.

A. Perkembangan Model Atom
1. Model atom Dalton
Model atom Dalton, seperti bola pejal
2. Model atom Thomson
Model atom Thomson seperti roti kismis
3. Model atom Rutherford
Model atom Rutherford tata surya
4. Model atom Bohr
Model atom Niels Bohr
5. Model atom Mekanika Gelombang
Model atom mekanika kuantum
B. Struktur Atom
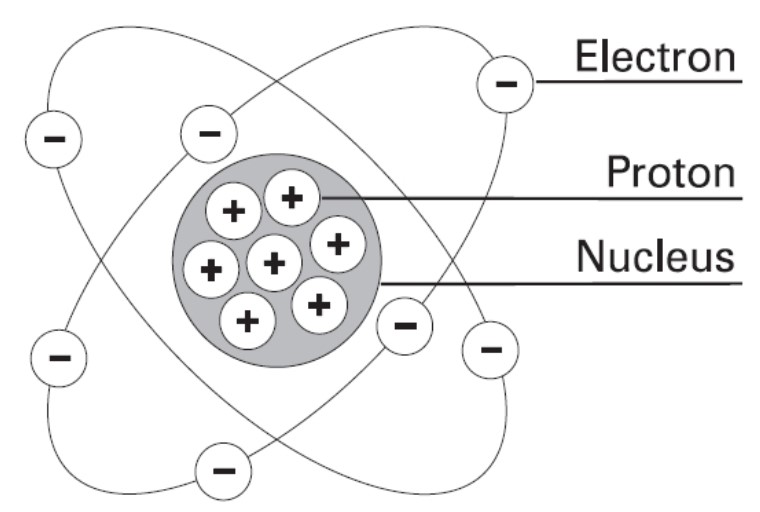
1. Elektron
Elektron adalah partikel penyusun atom yang bermuatan negative. Penemuan elektron bermula dengan ditemukannya tabung sinar katoda.tabung sinar katoda terbuat dari dua kawat yang diberi potensial listrik yang cukup besar dalam tabung kaca sehingga terjadi pembendaharaan cahaya . JJ Thomson meneliti lebih lanjut tentang sinar katoda ini dan dapat dipastikan bahwa sinar katoda merupakan partikel, sebab dapat memutar baling-baling yang diletakkan di antara katoda dan anoda. Dari hasil percobaan tersebut JJ Thomson menyatakan bahwa sinar katoda merupakan partikel penyusun atom yang bermuatan negative yang disebut dengan elektron.
Pembelokan sinar katoda oleh medan listrik
Besarnya muatan atom dalam elektron ditemukan oleh Robet Andrew Millikan melalui percobaan tetes minyak Milikan.
Diagram percobaan tetes minyak Milikan
2. Proton
Jika massa elektron 0 berarti suatu partikel tidak mempunyai massa padahal partikel materi mempunyai massa yang dapat di ukur.begitu pula kenyataan bahwa atom itu netral.
Eugene Goldstein (1886) melakukan eksperimen dari tabung gas yang memiliki katoda, yang diberi lubang-lubang dan diberi muatan listrik.
Percobaan Goldstein untuk mempelajari partikel positif
Ternyata pada saat terbentuk elektron yang menuju anoda terbentuk pula sinar positif yang menuju arah berlawanan melewati lubang pada katoda. Setelah berbagai gas dicoba dalam tabung ini, ternyata gas hidrogenlah yang menghasilkan sinar muatan positif yang paling kecil baik massa maupun muatannya, sehingga partikel ini disebut dengan proton. Massa proton = 1 sma ( satuan massa atom) dan muatan proton = +1
3. Inti Atom
Setelah penemuan proton dan elektron, Ernest Rutherford melakukan penelitian penembakan lempeng tipis. Jika atom terdiri dari partikel yang bermuatan positif dan negative maka sinar alpha yang ditembakkan seharusnya tidak ada yang diteruskan/ menembus lempeng sehingga muncullah istilah inti atom.
Ernest Rutherford dibantu oleh Hans Geiger dan Ernest Marsden menemukan konsep inti atom didukung oleh penemuan sinar X oleh W.C Rontgen dan penemuan zat radioaktif.
Percobaan Rutherford dapat digambarkan sebagai berikut :
Percobaan Rutherford, hamburan sinar alpha oleh lempeng tipis
4. Neutron
Prediksi dari Rutherford memacu W. Bothe dan H. Becker melakukan eksperimen penembakan partikel alpha pada inti atom Berilium (Be). Ternyata dihasilkan radiasi partikel berdaya tembus tinggi.
Eksperimen ini dilanjutkan oleh James Chadwick. Ternyata partikel yang menimbulkan radiasi berdaya tembus tinggi itu bersifat netral atau tidak bermuatan dan massanya hampir sama dengan proton. Partikel ini disebut neutron dan dilambangkan dengan 01n.


Isotop, Isobar dan isoton
C. Perkembangan Sistem Periodik
Logam & non logam
1. Triade Dobereiner
2. Hukum Oktaf Newlands
3. Sistem Periodik Mendeleyev
4. Sistem Periodik Modern
Dibagi 2 lajur, yaitu:
1. Lajur horisontal
Disebut periode, unsur-unsur disusun berdasarkan kenaikan nomor atom dan terdiri dari 7 periode
2. Lajur vertikal
Disebut golongan, unsur-unsur dalam satu golongan mempunyai sifat-sifat kimia yang sama.
Golongan dibedakan atas golongan utama (A) dan golongan transisi (B)
Konfigurasi Eletron dan Menentukan Periode dan Golongan
Sifat Periodik Unsur-unsur
sumber : https://sites.google.com/site/trayda1afrianti/materi/kelas-x/struktur-atom
dan http://kimiashs.blogspot.com/2015/01/kelas-x-bab-ii-struktur-atom-dan-sistem.html
ABSEN YA GUYS!!! https://forms.gle/1gra3kT1Rk52UXix9
soal (TUGAS)
1. Elektron dapat berpindah dari suatu lintasan ke lintasan yang lain sambil menyerap atau memancarkan energi. Teori ini merupakan penyempurnaan teori atom Rutherford yang dikemukakan oleh . . . .
2. Kelemahan model atom Rutherford adalah . . . .
3. Model atom Dalton digambarkan sebagai bola yang berbentuk bulat masif. Kelemahan model atom ini adalah . . . .
4. Gas yang digunakan oleh Eugene Goldstein pada percobaan tabung gas berkatoda adalah . . . .
5. Pada percobaan hamburan sinar alfa melalui penembakan lempeng emas tipis, Rutherford memperoleh hipotesis bahwa . . . .
6. Atom Natrium mempunyai nomor massa 23 dan nomor atom 11. Atom ini mempunyai . . . .
7. Semua isotop dari suatu unsur mempunyai persamaan dalam hal . . . .
8. Jika nomor massa unsur A adalah 30 dan A mempunyai elektron sebanyak 12 maka jumlah neutron unsur A adalah . . . .
9. Jumlah neutron dalam suatu atom dengan nomor atom 18 dan nomor massa 40 adalah . . . .
10. Apabila jumlah elektron valensi suatu unsur yang berada pada kulit ketiga adalah 7, nomor atom unsur tersebut adalah . . . .
sumber:
catatan
* Untuk kelas X MIPA 1 dan 2 tugas dikumpulkan Kamis tanggal 13 April 2020
| Partikel | Simbol | Muatan | Penemu |
| Proton | 1p1 | +1 | Goldstein(1886) |
| Neutron | 0n1 | 0 | James Chadwick (1932) |
| Elektron | -1e0 | -1 | J.J. Thomson(1897) |
| Inti atom | Rutherford(1910) | ||
| Kulit elektron | Niels Bohr(1914) |
J.J Thomson menemukan Elektron dia melakukan percobaan Sinar Katode.
Muatan elektron ini ditemukan sama Robert Milikan lewat percobaan tetesan halus minyak.
Sifat – sifat yang ada di Sinar katode:
Eungene Goldstein menemukan Proton dengan melakukan percobaan sinar katode yang udah dimodifikasi, yaitu memberi lubang (saluran) di tengah Katode.
Sifat – sifat Sinar Anode (sinar terusan):
James Chadwick menemukan Neutron melakukan percobaan dengan menembaki atom Berilium dengan sinar alfa. Neutron gak bermuatan.
Ernest Rutherford dengan 2 muridnya yaitu Hans Geiger dan Ernest Marsden dengan nama Eksperimen penghamburan sinar alpha.
Inti atom tersusun atas proton dan neutron. Proton dan neutron disebut yaitu nukleon.
1. Konfigurasi Elektron
Konfigurasi elektron menggambarkan penyebaran atau susunan elektron dalam atom. Pengisian elektron pada kulit – kulit atom memenuhi aturan tertentu, yaitu:
Jumlah maksiumum elektron pada suatu kulit memenuhi rumus 2n2, dengan n = nomor kulit.
Contohnya:
Maka, Jumlah maksimum elektron pada kulit terluar adalah 8
Elektron valensi yaitu elektron pada kulit terluar yang bisa dipakai buat membentuk ikatan kimia.
Susunan elektron valensi sangat menentukan sifat – sifat kimia suatu atom. Unsur yang memiliki struktur elektron valensi yang sama dan sifat kimia yang sama.
Contohnya:
11Na : K L M
2 8 18
Jumlah kulit = 3
Kulit terluar = M
Elektron valensi = 18
Nomor atom suatu unsur sama dengan jumlah proton. Buat atom netral, jumlah proton = jumlah elektron.
No. Atom = Jumlah proton = Jumlah elektron
Contohnya: Atom Oksigen bernomor atom 8 jadi memiliki 8 proton dan 8 elektron.
Nomor massa yaitu jumlah nukleon (proton dan neutron) yang ada di dalam inti atom.
No. Massa = Jumlah proton + Jumlah neutron
Contohnya: Atom natrium terdiri atas 11 proton dan 12 neutron, berarti nomor massa atom natrium = 11 + 12 = 23
Susunan suatu unsur netral bisa dinyatakan dengan lambang dibawah ini:
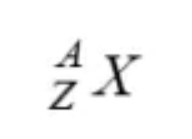
Dimana :
X = lambang unsur/notasi unsur
Z = nomor atom atau jumlah proton dalam inti (p) atau jumlah elektron yang mengelilingi inti
A= nomor massa atau jumlah proton + jumlah neutron (n)
n = neutron (n = A – Z)
Rumusnya:
p = Z | | p = Z

Isotop yaitu sebuat atom – atom unsur yang mempunyai nomor atom sama (proton), tapi nomor massanya berbeda.
Contohnya:
Karbon alam terdiri atas 2 jenis isotop yaitu 6C12 dan 6C13
Isobar yaitu sebuah atom – atom unsur yang berbeda (nomor atom berbeda), tapi mempunyai nomor massa yang sama.
Contohnya:
Isotop 6C14 yaitu isobar dengan isotop 7N14
Isoton yaitu sebuat atom – atom unsur yang berbeda (nomor atom berbeda), tapi mempunyai jumlah neutron yang sama.
Contohnya:
Isotop 6C13 dan isotop 7N14 yaitu isoton (keduanya
mempunyai 7 neutron).