Kali ini kita akan membahas mengenai struktur atom, konfigurasi elektron, elektron valensi, dan nomor atom, serta ISOTOP, ISOTON, dan ISOBAR
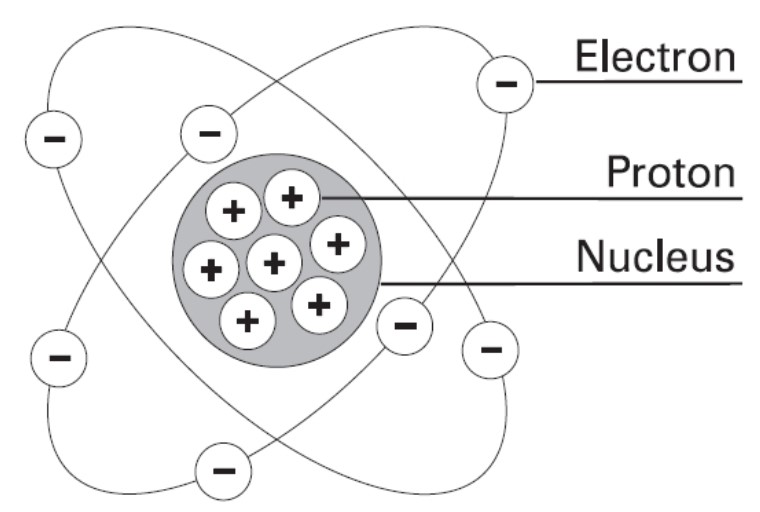
Partikel Penyusun Atom (Struktur)
| Partikel | Simbol | Muatan | Penemu |
| Proton | 1p1 | +1 | Goldstein(1886) |
| Neutron | 0n1 | 0 | James Chadwick (1932) |
| Elektron | -1e0 | -1 | J.J. Thomson(1897) |
| Inti atom | Rutherford(1910) | ||
| Kulit elektron | Niels Bohr(1914) |
1. Penemuan Elektron
J.J Thomson menemukan Elektron dia melakukan percobaan Sinar Katode.
Muatan elektron ini ditemukan sama Robert Milikan lewat percobaan tetesan halus minyak.
Sifat – sifat yang ada di Sinar katode:
- Merambat tegak lurus dari permukaan katode menuju anode
- Merupakan radiasi partikel, terbukti bisa memutar kincir
- Bermuatan listrik negatif jadi dibelokkan ke kutub positif
- Bisa memendarkan berbagai jenis zat, termasuk gelas
2. Penemuan Proton
Eungene Goldstein menemukan Proton dengan melakukan percobaan sinar katode yang udah dimodifikasi, yaitu memberi lubang (saluran) di tengah Katode.
Sifat – sifat Sinar Anode (sinar terusan):
- Merupakan radiasi partikel (bisa memutar kincir)
- Dalam medan listrik atau magnet dibelokkan ke kutub negatif, jadi merupakan radiasi bermuatan positif
- Partikel sinar terusan tergantung pada jenis gas dalam tabung
3. Penemuan Neutron
James Chadwick menemukan Neutron melakukan percobaan dengan menembaki atom Berilium dengan sinar alfa. Neutron gak bermuatan.
4. Penemuan Inti Atom
Ernest Rutherford dengan 2 muridnya yaitu Hans Geiger dan Ernest Marsden dengan nama Eksperimen penghamburan sinar alpha.
Inti atom tersusun atas proton dan neutron. Proton dan neutron disebut yaitu nukleon.
Konfigurasi Elektron dan Elektron Valensi
1. Konfigurasi Elektron
Konfigurasi elektron menggambarkan penyebaran atau susunan elektron dalam atom. Pengisian elektron pada kulit – kulit atom memenuhi aturan tertentu, yaitu:
Jumlah maksiumum elektron pada suatu kulit memenuhi rumus 2n2, dengan n = nomor kulit.
Contohnya:
- Kulit K (n = 1) maksimum 2 . 12 = 2 elektron
- Kulit L ( n = 2) maksimum 2. 22 = 4 elektron
- Kulit M ( n = 3) maksimum 2 . 32 = 18 elektron
Maka, Jumlah maksimum elektron pada kulit terluar adalah 8
2. Elektron Valensi
Elektron valensi yaitu elektron pada kulit terluar yang bisa dipakai buat membentuk ikatan kimia.
Susunan elektron valensi sangat menentukan sifat – sifat kimia suatu atom. Unsur yang memiliki struktur elektron valensi yang sama dan sifat kimia yang sama.
Contohnya:
11Na : K L M
2 8 18
Jumlah kulit = 3
Kulit terluar = M
Elektron valensi = 18
Nama Atom dan Nomor Massa
1. Nomor Atom (Z)
Nomor atom suatu unsur sama dengan jumlah proton. Buat atom netral, jumlah proton = jumlah elektron.
No. Atom = Jumlah proton = Jumlah elektron
Contohnya: Atom Oksigen bernomor atom 8 jadi memiliki 8 proton dan 8 elektron.
2. Nomor Massa (A)
Nomor massa yaitu jumlah nukleon (proton dan neutron) yang ada di dalam inti atom.
No. Massa = Jumlah proton + Jumlah neutron
Contohnya: Atom natrium terdiri atas 11 proton dan 12 neutron, berarti nomor massa atom natrium = 11 + 12 = 23
3. Lambang Unsur (X)
Susunan suatu unsur netral bisa dinyatakan dengan lambang dibawah ini:
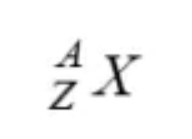
Dimana :
X = lambang unsur/notasi unsur
Z = nomor atom atau jumlah proton dalam inti (p) atau jumlah elektron yang mengelilingi inti
A= nomor massa atau jumlah proton + jumlah neutron (n)
n = neutron (n = A – Z)
Rumusnya:
p = Z | | p = Z
Isotop, Isobar dan Isoton

1. Isotop
Isotop yaitu sebuat atom – atom unsur yang mempunyai nomor atom sama (proton), tapi nomor massanya berbeda.
Contohnya:
Karbon alam terdiri atas 2 jenis isotop yaitu 6C12 dan 6C13
2. Isobar
Isobar yaitu sebuah atom – atom unsur yang berbeda (nomor atom berbeda), tapi mempunyai nomor massa yang sama.
Contohnya:
Isotop 6C14 yaitu isobar dengan isotop 7N14
3. Isoton
Isoton yaitu sebuat atom – atom unsur yang berbeda (nomor atom berbeda), tapi mempunyai jumlah neutron yang sama.
Contohnya:
Isotop 6C13 dan isotop 7N14 yaitu isoton (keduanya
mempunyai 7 neutron).







0 komentar:
Posting Komentar