Termokimia
Entalpi dan Perubahannya
Dalam hukum kekekalan energi berbunyi, “Energi tidak dapat diciptakan atau dimusnahkan, energi hanya dapat berubah dari satu bentuk energi ke bentuk energi lainnya”.
Besar energi kimia yang dimiliki suatu zat pada tekanan tetap disebut entalpi. Entalpi dinotasikan dengan “H” yang berarti “Heat content (panas yang tersimpan)”. Entalpi tidak akan berubah apabila tidak ada energi yang diserap atau dilepas.
Besarnya entalpi (H) pada suatu zat tidak dapat diukur, namun perubahan entalpinya (∆H) dapat diukur yang merupakan jumlah kalor yang diserap atau dilepas dari energi yang tersimpan.
∆H = Hproduk – Hreaktan
- Bila ∆H positif, artinya terdapat energi (kalor) yang diserap dari lingkungan ke sistem, reaksinya disebut reaksi endoterm (membutuhkan kalor).
- Sebaliknya, apabila ∆H negatif, artinya terdapat energi (kalor) yang dilepas dari sistem ke lingkungan, reaksinya disebut reaksi eksoterm (melepaskan kalor).
Sistem adalah bagian yang menjadi pusat pengamatan, sedangkan lingkungan adalah segala sesuatu yang ada di sekitar dan membatasi sistem.
Reaksi endoterm dicirikan dengan terjadinya penurunan suhu, sehingga suhu lingkungan menjadi dingin.
Sedangkan reaksi eksoterm dicirikan dengan terjadinya kenaikan suhu, sehingga suhu lingkungan menjadi panas.
ABSEN https://forms.gle/TjhmD4dLCXXBjLcv8
Persamaan Termokimia
Persamaan termokimia adalah persamaan reaksi kimia yang dilengkapi dengan besar perubahan entalpinya (∆H).
Satuan yang dipakai untuk menyatakan ∆H adalah kJ (kiloJoule) atau kkal (kilokalori).
Contoh
Persamaan termokimia dari reaksi pembentukan 1 mol metanol dari karbon, gas hidrogen, dan gas oksigen yang membebaskan kalor sebesar 238 kJ adalah sebagai berikut.
C (s) + 2H2 (g) + ½ O2 (g) → CH3OH ∆H = -238 kJ
Jenis-Jenis Perubahan Entalpi Standar
Jenis perubahan entalpi standar tergantung dari reaksi yang terjadi dan besarnya perubahan entalpi tergantung banyaknya zat yang direaksikan.
Ada beberapa jenis perubahan entalpi standar sebagai berikut.
1. Perubahan Entalpi Standar (∆H⁰)
Perubahan entalpi standar adalah pengukuran besarnya kalor yang diserap atau dibebaskan dari suatu reaksi yang berlangsung pada keadaan standar (suhu 25⁰ C dan tekanan 1 atm).
2. Perubahan Entalpi Pembentukan Standar (∆Hformation⁰/∆Hf⁰)
Perubahan entalpi pembentukan standar adalah pengukuran besarnya energi yang diserap atau dilepas untuk pembentukan 1 mol senyawa dari unsur-unsunya yang paling stabil pada keadaan standar.
Contoh
Persamaan termokimia dari reaksi pembentukan 1 mol NaCl yang membebaskan energi sebesar 77 kJ/mol adalah sebagai berikut.
Na (s) + ½ Cl2 (g) → NaCl (s) ∆Hf⁰ = -77 kJ
3. Perubahan Entalpi Penguraian Standar (∆Hdissociation⁰/∆Hd⁰)
Perubahan entalpi penguraian standar adalah pengukuran besarnya energi yang diserap atau dibebaskan untuk menguraikan 1 mol senyawa menjadi unsur-unsurnya yang paling stabil dalam keadaan standar.
Contoh
Persamaan termokimia dari reaksi penguraian 1 mol uap air yang membutuhkan energi sebesar 242 kJ adalah sebagai berikut.
H2O (g) → H2 (g) + ½ O2 (g) ∆Hd⁰ = +242 kJ
4. Perubahan Entalpi Pembakaran Standar (∆Hcombustion⁰/∆Hc⁰)
Perubahan entalpi pembakaran standar adalah pengukuran besarnya energi yang dilepaskan dari pembakaran 1 mol suatu zat.
Persamaan termokimia dari reaksi pembakaran 1 mol gas metana yang membebaskan energi sebesar 802 kJ adalah sebagai berikut.
CH4 (g) + 2O2 (g) → CO2 (g) + 2H2O (l) ∆Hc⁰ = -802 kJ
Menetukan Harga Perubahan Entalpi (∆H)
1. Menentukan besarnya energi yang diserap atau dibebaskan oleh air dengan kalorimeter
qair = m x c x ∆T
dimana
q = energi/kalor
m = massa air
c = kalor jenis air (4,18 J/gr.C)
∆T = perubahan suhu
Contoh Soal
Tentukan entalpi pembakaran standar metanol (Mr = 16) sebanyak 0,48 gram yang dibakar dalam kalorimeter yang berisi 500 gram air dan terjadi peningkatan suhu sebesar 15⁰C. Tulislah persamaan termokimianya.
Persamaan termokimia :
CH3OH + ½ O2 (g) → CO2 (g) + 2H2O (l) ∆Hc⁰ = -1045 kJ
qair = m x c x ∆T
qair = 500 gr x 4,18 J/gr.C x 15⁰C
qair = 31350 J
qair = 31,35 kJ
mol metanol = 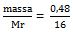 = 0,03 mol
= 0,03 mol
∆H pembakaran 0,03 mol metanol = -31,35 kJ
∆H pembakaran 1 mol metanol = 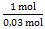 x (-31,35 kJ) = -1045 kJ
x (-31,35 kJ) = -1045 kJ
2. Menentukan besar ∆H berdasar Hukum Hess
Hukum Hess berbunyi, “Entalpi suatu reaksi tidak dipengaruhi oleh jalannya reaksi, akan tetapi hanya bergantung pada keadaan awal dan keadaan akhir….”.
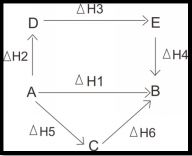
Proses I = A → B = ∆H1
Proses II = A → D = ∆H2
Proses II = D → E = ∆H3
Proses II = E → B = ∆H4
Proses III = A→ C = ∆H5
Proses III = C → B = ∆H6
∆Hproses I = ∆Hproses II = ∆Hproses III
∆H1 = ∆H2 + ∆H3 + ∆H4 = ∆H5 + ∆H6
Contoh Soal
Diketahui reaksi :
C6H12O6 + 6O2 → 6CO2 +6H2O ∆H = -2820 kJ
C2H5OH + 3O2 → 2CO2 + 3H2O ∆H = -1380 kJ
Tentukan perubahan entalpi (∆H) bagi reaksi fermentasi 360 gram glukosa (Mr = 180).
Reaksi fermentasi glukosa sebagai berikut.
C6H12O6 → 2C2H5OH + 2CO2
C6H12O6 + 6O2 → 6CO2 +6H2O ∆H = -2820 kJ
4CO2 + 6H2O → 2C2H5OH + 6O2
Reaksi : C6H12O6 → 2C2H5OH + 2CO2 ∆H = -60 kJ
mol C6H12O6 = 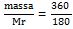 = 2 mol
= 2 mol
∆H untuk 2 mol glukosa = 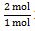 x (-60 kJ) = -120 kJ
x (-60 kJ) = -120 kJ
3. Menentukan besar ∆H berdasar entalpi pembentukan
Reaksi : aA + bB → cC + dD
∆Hreaksi = ∆Hf⁰produk – ∆Hf⁰reaktan
∆Hreaksi = (c . ∆Hf⁰C + d . ∆Hf⁰ D) – (a . ∆Hf⁰ A + b . ∆Hf⁰ B)
Contoh Soal
Diketahui data entalpi pembentukan standar :
C3H8 (g) = -104 kJ/mol
CO2 (g) = -394 kJ/mol
H2O (g) = -286 kJ/mol
Tentukan ∆H reaksi :
C3H8 (g) + 5O2 (g) → 3CO2 (g) + 4H2O (g)
∆Hreaksi = ∆Hf⁰produk – ∆Hf⁰reaktan
∆Hreaksi = (3 . ∆Hf⁰CO2 + 4 . ∆Hf⁰ H2O) – (1 . ∆Hf⁰ C3H8 + 5 . ∆Hf⁰ O2)
∆Hreaksi = (3 . (-394 kJ) + 4 . (-286 kJ)) – (1 . (-104 kJ) + 5 . 0)
∆Hreaksi = (-1182 kJ + (-1144 kJ)) – (-104 kJ)
∆Hreaksi = -2326 kJ + 104 kJ
∆Hreaksi = -2222 kJ
4. Menentukan besar ∆H berdasar energi ikatan
Pemutusan dan pembentukan ikatan menyebabkan terjadinya reaksi kimia. Perubahan entalpi dapat diketahui dari selisih ∆H pemutusan dan ∆H pembentukan ikatan.
∆H = ∑ energi pemutusan ikatan – ∑ energi pembentukan ikatan
Contoh Soal
Diketahui energi ikatan (kJ/mol) dari :
C – H = 413
O = O = 495
C = O = 799
O – H = 463
Tentukan perubahan entalpi (∆H) dari reaksi berikut.
CH4 (g) + 2O2 (g) → CO2 (g) + 2H2O (g)
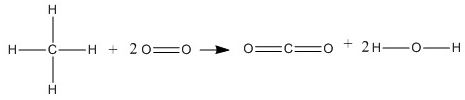
∆H = ∑ energi pemutusan ikatan – ∑ energi pembentukan ikatan
∆H = {(4 . C – H) + (2 . O = O)} – {(2 . C = O) + (4 . O – H)}
∆H = { 4 . 413 + 2 . 495} – {2 . 799 + 4 . 463}
∆H = 2642 kJ – 3450
∆H = -808 kJ
sumber : https://rumuspintar.com








0 komentar:
Posting Komentar